原創精選> 正文
一周藥聞 | 「三連漲」!騰盛博藥股價累升68%,新冠特效藥利好持續發酵
2022-07-11 13:59
一、醫藥板塊行情回顧
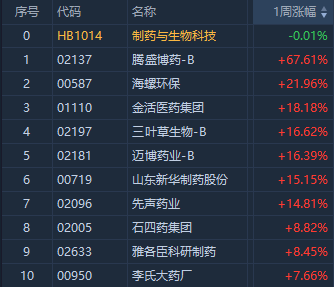
近期,受國產新冠中和抗體藥物在中國商業化上市利好刺激,新冠概念股較為活躍,其中騰盛博藥一周累計漲幅達67.6%。
三葉草生物-B(02197)周漲幅達14%,此前公司披露了SCB-2019(CpG1018/鋁佐劑)研發新進展,並指2022年將專注於完成該新冠候選疫苗作為通用加強針的開發。
山東新華製藥(0719.HK)周漲幅達15%,公司近日公告稱,鑑於中國醫學科學院藥物研究所(藥物所)擁有的LXH-2201項目的臨牀前研究和I期臨牀試驗研究已經完成,公司將出資人民幣1億元受讓該項目。
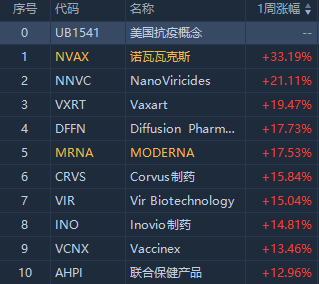
美股抗疫概念近一周同樣受捧,諾瓦瓦克斯醫藥周漲33%,股價受COVID-19 疫苗 NVX-CoV2373 在多個國家所獲授權推動;其他知名醫藥股Moderna周漲幅17.73%,Corvus製藥周漲15.81%。
美國食品和藥物管理局(FDA)表示,新冠疫苗製造商應該更新他們的新冠疫苗加強針,以針對最近在美國蔓延的奧密克戎BA.4和BA.5變異株。
公共衞生專家預計,隨着疫苗免疫力下降,以及待在室內的時間變長,新一輪感染潮很有可能出現。
二、醫藥板塊重點關注
- 騰盛博藥:首個國產新冠病毒中和抗體聯合治療藥物上市
近日,騰盛博藥及宣佈,其長效新冠中和抗體安巴韋單抗和羅米司韋單抗聯合療法在中國商業化上市,目前公司定價低於10,000人民幣/人份的定價策略,與美國中和抗體採購價趨同。自公告發布以來,該股連續3天走高,截至目前,騰盛博藥累計漲幅達68%。
安巴韋單抗和羅米司韋單抗聯合療法於2021年12月獲得國家藥品監督管理局(NMPA)上市批准,用於治療輕型和普通型且伴有進展為重型(包括住院或死亡)高風險因素的成人和青少年(12-17歲,體重≥40 kg)新型冠狀病毒感染(COVID-19)患者。其中青少年(12-17歲,體重≥40 kg)適應證人羣為附條件批准。這也是國產新冠病毒中和抗體聯合治療藥物獲批。
SVB Securities和UBS兩家國際投行均於近日繼續調高公司預期,維持推薦買入評級,其中SVB Securities調高目標價至每股21港幣,UBS調高目標價至每股26.4港幣。

- 兩針上萬元,全球首款新冠預防藥於海南開打
近一周,由阿斯利康公司研發的全球唯一一款可用於新冠病毒感染預防藥物Evusheld(恩適得)在中國大陸首次先行先試准入,近日落地海南博鰲樂城國際醫療旅遊先行區,適用於成人和青少年(年齡≥12歲且體重≥40kg)的新冠病毒暴露前預防。工作人員表示,「恩適得一次性要打兩針,打完以后很快就可以產生抗體。產生的抗體能維持半年,半年以后還可以再用藥」。
- FDA重新受理君實生物PD-1特瑞普利單抗上市申請
君實生物7月7日晚間公告,重新提交PD-1藥物特瑞普利單抗(項目代號:TAB001/JS001)聯合吉西他濱/順鉑作為晚期復發或轉移性鼻咽癌患者的一 線治療和單藥用於復發或轉移性鼻咽癌含鉑治療后的二線及以上治療的生物製品許可申請獲FDA受理。
如獲批准,君實生物的合作伙伴 Coherus BioSciences, Inc.計劃於2023年第一季度在美國推出特瑞普利單抗,特瑞普利單抗也將成為美國首個且唯一用於鼻咽癌治療的腫瘤免疫藥物
- 百濟神州入局mRNA:與深信生物達成戰略合作
7月6日,百濟神州宣佈與深信生物(InnoRNA)達成全球戰略合作,藉助深信生物的創新技術平臺共同開發mRNA創新產品。根據協議條款,百濟神州與深信生物將共同推進數個mRNA-LNP項目的研發工作,百濟神州將獲得這些項目候選產品的全球獨家開發和商業化權利,並獲得深信生物專有LNP技術的非獨家使用許可,用於支持內部研發工作
- 馬來西亞:推薦康希諾生物腺病毒載體新冠疫苗作「加強針」
7月6日,馬來西亞衞生部在其官方社交媒體宣佈,推薦使用中國康希諾生物腺病毒載體新冠疫苗克威莎作為第二輪「加強針」候選疫苗,即第四針候選疫苗。接種羣體為當地18歲至59歲的高風險民眾及一線醫護人員。
公開數據顯示,7月6日,馬來西亞新增新冠感染2932例,較5月底的日增8000多例的嚴峻形勢來説有所緩解,但形勢仍然不容樂觀,尤其是馬來西亞作為東南亞的旅遊業大國,加強疫苗接種仍是儘快阻斷疫情、恢復旅遊業和經濟的最有效的方法。
- 傳奇生物終止第二款CAR-T在美臨牀
7月7日,傳奇生物通知美國食品藥品監督管理局(FDA),終止其針對CAR-T 新藥LB1901的新藥臨牀試驗申請(IND)的1期臨牀試驗。LB1901是傳奇生物的一項針對惡性CD4+ T細胞的試驗性自體CAR-T療法,用於治療復發或難治性T細胞淋巴瘤(TCL)的成人患者,在國內和美國均已推進至臨牀Ⅰ期階段。此次,傳奇生物徹底終止了LB1901的1期臨牀試驗。
編輯:Amy
風險及免責提示:以上內容僅代表作者的個人立場和觀點,不代表華盛的任何立場,華盛亦無法證實上述內容的真實性、準確性和原創性。投資者在做出任何投資決定前,應結合自身情況,考慮投資產品的風險。必要時,請諮詢專業投資顧問的意見。華盛不提供任何投資建議,對此亦不做任何承諾和保證。
推薦文章
美股機會日報 | 就業數據轉弱!美國至2月7日當周初請失業金人數超預期;存儲概念股盤前齊升,閃迪大漲超7%
要點速遞!《跑贏美股》春節特別直播核心觀點總結
華盛早報 | 非農數據大超預期!首次降息或延至7月;AI恐慌交易蔓延至房地產服務板塊, CBRE暴跌12%;智譜發佈新模型
美股機會日報 | 經濟數據強勁!美國1月非農就業大超預期,納指期貨漲至0.6%;AI應用股業績超預期,Shopify漲超10%
資金覆盤 | 北水淨買入港股超48億港元,逾7億港元搶籌騰訊
華盛早報 | 「AI威脅」波及華爾街!財富管理公司全線暴跌;豆包官宣「參戰」!春節AI紅包戰愈演愈烈
美股機會日報 | 科技巨頭迎利好?特朗普政府擬結構性豁免芯片關税;臺積電1月銷售額創歷史新高,盤前股價漲近3%
一圖看懂 | 淨利大增60.7%!中芯國際Q4營收24.9億美元,同比增長12.8%

